Appetitregulering er et komplekst system, som det vil fremgå af omstående artikel.
Imidlertid har du en trumf på hånden….den menneskelige beviste vilje og mål rettede handling givet dig mulighed for at gribe målrette ind i systemet.
Men hvis du modsat vælger ikke gør noget, vil du være underlagt den “kropslige-programmering” som var ur-mennesket nødvendig i før stenalderen. Et “mave-mad-ur” som skulle kalde til handling i god tid, nå man ikke bare kunne gå ud og kikke i køleskabet…
– Er det dig “der skal styre bussen”, kræver det en anden form for handling fra dig.
Her i teksten neden for, skal du særligt være opmærksom på dette afsnit i teksten: – “Perifere signaler i appetitreguleringen”
- Når vi indtager føde, udspiles mavesækken, og der sendes signal til centralnervesystemet om fyldning af maven(10). I den forbindelse kan energitætheden af maden påvirke vores følelse af mæthed, da mad med en højere energitæthed vil fylde mindre i maven.
- Foruden udspilingen af mavesækken, ved man, at mavesækstømningshastigheden er af betydning for vores sultfornemmelse. – Således vil en langsommere mavesækstømningshastighed bevirke en øget mæthedsfornemmelse sammenlignet med en hurtigere tømning af mavesækken.
Dette har betydning i relation til f.eks. flydende fødeemner, såsom energi- og læske-drikke, samt såkaldte “tomme kalorier”, at de mætte mindre end en tilsvarende energimængde fra et fast måltid(12).
Og bemærk !…. Så, dette er vigtig i dit bevidste valg, i forhold til dine valg for at opnå varig vægttab.:
- Både fibre, protein og fedt kan også nedsætte mavesækstømningshastigheden og således bevirke en langsommere optagelse af det indtagne måltid.
Netop alt det føde ur-mennesket kunne finde på deres jagt efter noget at spise…
Her er overhoved ingen anbefalinger om stivelse, pizza og pasta eller andre fastfood/færdig-ret-produkter.
Når det moderne menneske går på “jagt” i det lokale supermarked kræver det bevidste valg for ikke at komme hjem med fødemidler med høj energitæthed……, – mange kalorier per 100 gram…
Det var lige min indledning, men forstå…. Appetitregulering er et komplekst system, men den menneskelig vilje og handleevne, er også dig en mulighed….
“Appetitregulering: et komplekst system”
- Af Birgitte Sloth, adjunkt, Institut for Human Ernæring, Det Biovidenskabelige Fakultet for Fødevarer, Veterinærmedicin og Naturressourcer, og Jens Juul Holst, professor, Det Sundhedsvidenskabelige Fakultet, Biomedicinsk Institut, Københavns Universit
Det er velkendt, at overvægt er resultatet af en ubalance mellem energiindtaget og energiforbruget, og vi ved, at et overskydende energiindtag på bare 100 kcal/dag er nok til at inducere en vægtøgning(1).
Årsagerne til ubalance mellem energiindtag og -forbrug og til den manglende succes i forsøgene på at vende den uheldige udvikling med stigende fedmeprævalens er mange, og fedme kan derfor ikke tilskrives en enkelt fejlslagen faktor, men bør opfattes som en multifaktorielt udviklet tilstand.
Samfundets udvikling hen mod en livsstil med mindre fysisk aktivitet som følge af mere stillesiddende arbejde og mere fritid, set i forhold til tidligere tiders langvarige manuelle arbejde, anses generelt for at være en vigtig faktor i fedmeudviklingen.
Den lavere fysiske aktivitet kræver et lavere energiindtag for at opretholde vægtstabilitet, men med den øgede og nemmere tilgang til mad, herunder en række energitætte, velsmagende fødevarer, såsom fastfood, snackprodukter og læskedrikke, er det svært at reducere energiindtaget, også fordi vores appetitregulering i højere grad er gearet til at sikre bevaring af vores kropsvægt og i mindre grad til at beskytte mod overvægt i et samfund med overflod af mad.
Foruden de ovenfor nævnte miljømæssige faktorer er genetisk prædisponering formentlig også en del af forklaringen på den øgede fedmeprævalens, eftersom den evolutionære udvikling med al sandsynlighed har favoriseret evnen til at modstå hungersnød og sult2. Således vil en sænkning i energiindtaget og medfølgende vægttab resultere i en række fysiologiske responser, der ved at øge appetitten og nedsætte energiomsætningen søger at genoprette den oprindelige kropsvægt(2).
Hvorvidt en person med en genetisk prædisponering for fedme udvikler overvægt, er dog i høj grad afhængigt af faktorer i det omgivende miljø, såsom ernæringsmæssig kvalitet af maden og muligheder for og behovet for fysisk udfoldelse(3-5).
Appetitregulering:
Appetitregulering er en term, der bruges til at beskrive reguleringen af energiindtaget i forhold til energiforbruget. Appetitregulering bør betragtes som et redundant system forstået således, at det er et system bestående af en række overlappende undersystemer, der ikke alle behøver at være til stede eller optimalt fungerende for at sikre, at det overordnede system kan fungere(6).
Den fysiologiske del af appetitreguleringen består af en række centre i centralnervesystemet, der via neurologiske signalveje og en række blodbårne signalstoffer kommunikerer med periferien og vice versa(6,7). Dette betyder, at selvom kognitive, sociale og kulturelle faktorer til dels kontrollerer, hvornår, hvad og hvor meget vi spiser, så er en stor del af vores appetitregulering kontrolleret af komplekse fysiologiske systemer.
Sagt med andre ord er vores energiindtag styret af et samspil mellem interne (genetiske, fysiologiske og neurokemiske) og eksterne (miljømæssige og psykosociale) faktorer8.
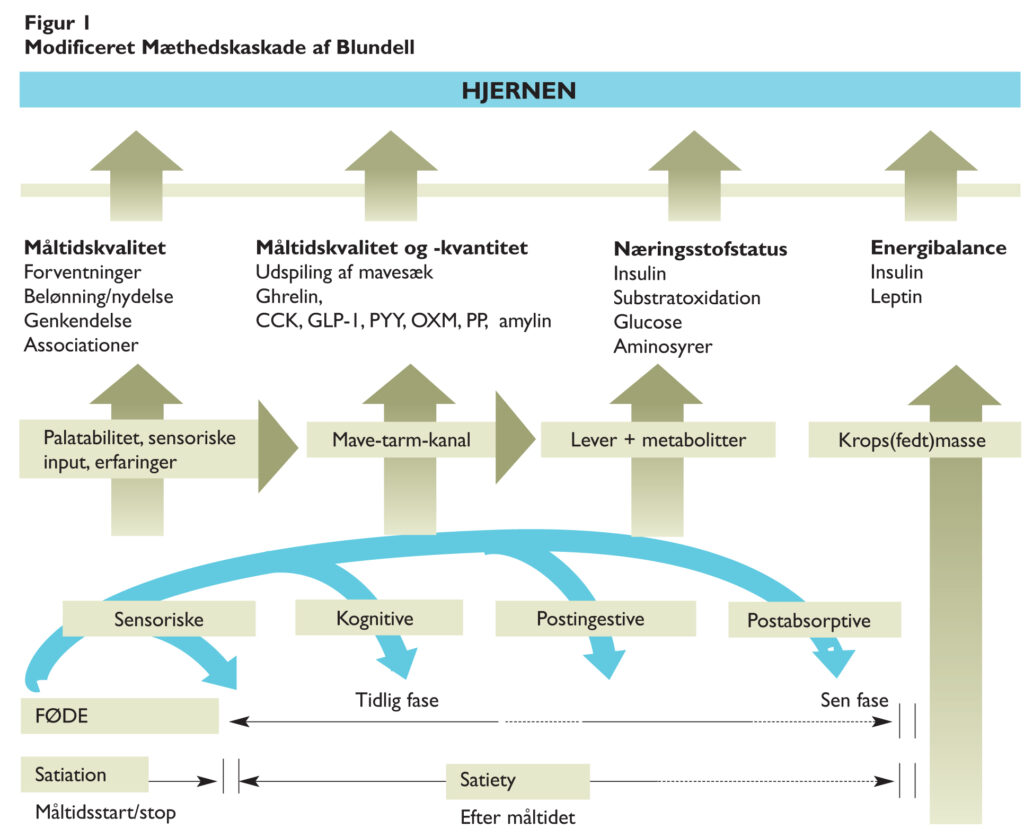
Det komplekse appetitregulerende system har ofte været illustreret ved hjælp af mæthedskaskaden, der i sin tid blev introduceret af John Blundell fra Leeds University(7).
Mæthedskaskaden beskriver fire forskellige, men overlappende kategorier af mekanismer, som er involveret i dels den akutte mæthed, som opstår under et måltid (på engelsk: satiation), samt mæthedsfølelsen mellem to måltider (på engelsk: satiety)
De fire kategorier af mekanismer er sensoriske, kognitive, postingestive og postabsorptive. Den sensoriske fase inkluderer stimuli medieret via de sensoriske fibre i kranienerverne og relaterer til palatabiliteten af det indtagne måltid, hvilket vil sige lugt, smag, temperatur og tekstur(8). Den kognitive fase i mæthedskaskaden inkluderer erfaringer fra vores habituelle fødeindtag og den grad af mæthed, vi normalt oplever i forbindelse med indtag af en given fødevare, såvel som sociale normer, personlige holdninger og psykologiske faktorer relateret til fødeindtaget8. I den postingestive fase er mave-tarm-kanalen ansvarlig for afsendelsen af en række mæthedssignaler udløst via både kemiske og mekaniske receptorer og medieret dels af sensoriske nerver og dels af en række appetitregulerende hormoner frigivet fra mave-tarm-kanal og bugspytkirtel, der enten via cirkulationen kommer i direkte kontakt med appetitregulerende centre i hjernen, eller som via vagusnerven kan påvirke de selvsamme centre. Den sidste kategori af mekanismer i mæthedskaskaden, de postabsorptive mekanismer, menes at inkludere niveauet af optagede næringsstoffer (såsom blodglukosekoncentrationen) og signaler opstået som følge af forskelle i energiomsætning, substratoxidation. Som i den postingestive fase indgår også forskellige neurohormonelle faktorer(7,9).
Perifere signaler i appetitreguleringen
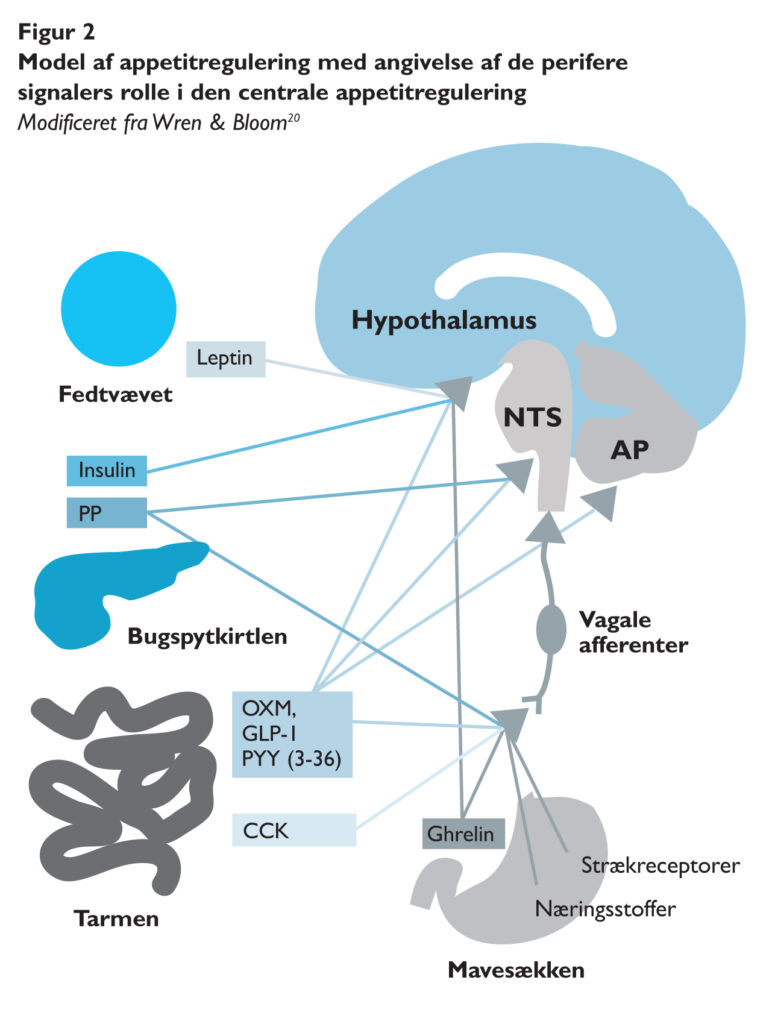
Når vi indtager føde, udspiles mavesækken, og der sendes via mekanoreceptorer et vagusmedieret signal til centralnervesystemet om fyldthed af maven(10). I den forbindelse kan energitætheden af maden påvirke vores følelse af mæthed, da mad med en højere energitæthed vil fylde mindre i maven. Fra mavesækken kommer også det eneste appetitfremmende hormon, nemlig ghrelin. Koncentrationen af ghrelin i blodet er stigende op til et måltid og falder efter indtagelse af et måltid, og ghrelin menes bl.a. på denne baggrund at være et såkaldt måltidsinitierende hormon. Man har i flere studier vist, at ghrelinindgivelse kan øge energiindtaget hos f.eks. cancerpatienter(11).
Foruden udspilingen af mavesækken og koncentrationerne af ghrelin ved man, at mavesækstømningshastigheden er af betydning for vores sultfornemmelse. Således vil en langsommere mavesækstømningshastighed bevirke en øget mæthedsfornemmelse sammenlignet med en hurtigere tømning af mavesækken. Dette har betydning i relation til f.eks. flydende fødeemner, såsom læskedrikke, der menes at mætte mindre end en tilsvarende energimængde fra et fast måltid(12). Både fibre, protein og fedt kan også nedsætte mavesækstømningshastigheden og således bevirke en langsommere optagelse af det indtagne måltid.
Siden 1990’erne, hvor forskerne opdagede hormonet leptin, der udskilles i fedtvævet, og at mus uden leptin udviklede en markant overvægt grundet øget sult og energiindtag, har forskningen fokuseret meget på perifere appetitregulerende hormoner(13,14).
De forskellige appetitregulerende hormoner opdeles generelt i to brede kategorier:
1) De såkaldte adipositas-signaler, der menes at levere signaler til centralnervesystemet omkring kroppens fedtlagre, og
2) mæthedssignalerne, der bliver frigivet som respons til et måltid og menes at være involveret i korttidsreguleringen af energiindtaget(15,16).
De nuværende kendte adipositassignaler inkluderer insulin og leptin, hvis udskillelse øges i takt med graden af overvægt, og som begge menes at være langtidsvirkende signaler til reduktion af energiindtaget. Blandt de korttidsregulerende appetitregulerende hormoner findes foruden det nævnte appetitstimulerende ghrelin en række korttidsregulerende mæthedssignaler udskilt fra tarmen og bugspytkirtlen.
Allerede når maden når til tolvfingertarmen, udskilles hormonet cholecystokinin (CCK), der via vagusnerven signalerer mæthed til de appetitregulerende centre i hjernen. Længere nede i tarmen udskiller de såkaldte L-celler mæthedshormonerne peptid YY (PYY), glukagonlignende peptid-I (GLP-1) og oxyntomodulin (OXM), der alle tre virker via vagusnerverne eller direkte på receptorer i hjernen. Fra bugspytkirtlen udskilles som respons på et måltid både insulin, pankreatisk polypeptid (PP) og amylin, der alle kan indvirke på appetitten(17).
Indgivelse af de ovenfor nævnte mæthedshormoner har i en række forsøg vist sig at kunne øge mætheden og nedsætte energiindtaget ved et måltid serveret efter indgivelse. Det er på den baggrund, vi betegner dem mæthedshormoner, og de er i høj grad interessante i fedmebekæmpelse, da en øget koncentration af disse mæthedshormoner i blodet kan være med til at sænke energiindtaget. Der arbejdes derfor med disse hormoner som kandidater for farmakologisk fedmebehandling, men der er også en stor interesse for udforskning af de faktorer, der styrer den naturlige udskillelse af disse mæthedssignaler.
Man ved således, at faktorer, såsom energiindholdet, makronæringsstofsammensætningen og fiberindholdet i et måltid, kan have betydning for den udskilte mængde af disse hormoner, og det er ikke utænkeligt, at forskellige bioaktive komponenter i kosten ligeledes kan påvirke disses udskillelse. Ved at udvikle fødevarer og måltider med den rette sammensætning vil man i højere grad kunne påvirke de endogene mæthedssignaler og derved undgå overspisning.
Den centrale appetitregulering
De ovenfor beskrevne perifere signaler virker for manges vedkommende på appetitregulerende centre i hypothalamus, hvorunder nukleus arkuatus anses for at være et centralt center i den fysiologiske appetitregulering. Foruden nucleus arcuatus (ARC) modtager hjernestammens nucleus tractus solitarius (NTS) samt area postrema (AP) input fra vagale afferenter samt en række cirkulerende faktorer, og disse centre samspiller med hypothalamus(15,18). Hypothalamus er ligeledes i samspil med nukleus accumbens, hvorved appetitreguleringen kommer til at interagere med hjernens belønningscenter. Her vides aktivering af de såkaldte cannabinoid-receptorer (receptorer for cannabis, men også endocannabinoider, cannabis-lignende stoffer, som produceres i kroppen) at påvirke appetitten(19).
Opdagelsen af det appetithæmmende hormon leptin og påvisningen af receptorer for leptin i arcuatuskernen har betydet et gennembrud for udforskningen af de mekanismer, der indgår i den centrale appetitregulering. F.eks. ved man, at visse mutationer i gener, der koder for nogle af de medvirkende receptorer, er ansvarlige for ikke helt få tilfælde af tidlig udviklet fedme. Det øgede kendskab til de signalstoffer, der medvirker, har derfor skabt forventninger om, at det vil være muligt at fremstille lægemidler, der via påvirkning af disse mekanismer kan regulere fødeindtagelsen.
Referencer
1.Hill JO, Wyatt HR, Reed GW, Peters JC. Obesity and the environment: where do we go from here? Science 2003;299:853-5.
2.Neel JV. The “thrifty genotype” in 1998. Nutr Rev 1999;57:S2-S9.
3.Bouchard C, Savard R, Despres JP, Tremblay A, Leblanc C. Body composition in adopted and biological siblings. Hum Biol 1985;57:61-75.
4.Bouchard C, Tremblay A. Genetic influences on the response of body fat and fat distribution to positive and negative energy balances in human identical twins. J Nutr 1997;127:943S-7S.
5.De Castro JM. Heritability of hunger relationships with food intake in free-living humans. Physiol Behav 1999;67:249-58.
6.Blundell J, Stubbs J. Diet composition and the control of food intake in humans. In: Bray GA, Bouchard C, eds. Handbook of obesity. New York, Basel: Marcel Dekker Inc. 2004:427-60.
7.Blundell JE, Halford JC. Regulation of nutrient supply: the brain and appetite control. Proc Nutr Soc 1994;53:407-18.
8.Smith GP. The direct and indirect controls of meal size. Neuroscience & Biobehavioral Reviews 1996;20:41-6.
9.Blundell JE. Appetite disturbance and the problems of overweight. Drugs 1990;39 Suppl 3:1-19.
10.Geliebter A. Gastric distension and gastric capacity in relation to food intake in humans. Physiol Behav 1988;44:665-8.
11.Higgins SC, Gueorguiev M, Korbonits M. Ghrelin, the peripheral hunger hormone. Ann Med 2007;39:116-36.
12.Tieken SM, Leidy HJ, Stull AJ, Mattes RD, Schuster RA, Campbell WW. Effects of solid versus liquid meal-replacement products of similar energy content on hunger, satiety, and appetite-regulating hormones in older adults. Horm Metab Res 2007;39:389-94.
13.Lee GH, Proenca R, Montez JM et al. Abnormal splicing of the leptin receptor in diabetic mice. Nature 1996;379:632-5.
14.Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature 1994;372:425-32.
15.Schwartz MW, Woods SC. Central nervous system control of food intake. Nature 2000;404:661.
16.Woods SC. Signals that influence food intake and body weight. Physiology & Behavior 2005;86:709-16.
17.Chaudhri O, Small C, Bloom S. Gastrointestinal hormones regulating appetite. Philos Trans R Soc Lond B Biol Sci 2006;361:1187-209.
18.Wren AM, Bloom SR. Gut hormones and appetite control. Gastroenterology 2007;132:2116-30.
19.Arias HF. Cannabinoids in eating disorders and obesity. Mol Neurobiol 2007;36:113-28.